合作客戶/
拜耳公司 |
同濟大學(xué) |
聯(lián)合大學(xué) |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關(guān)新聞Info
-
> 單片機智能控制的液體表面張力測量儀設(shè)計
> 高速運動的微小水滴撞擊深水液池產(chǎn)生的空腔運動及形成機理(一)
> 液滴撞擊固體表面過程中黏度與表面張力系數(shù)變化(二)
> 一起和孩子做“科學(xué)小實驗”,超有趣的科學(xué)小實驗!
> 一文讀懂烷基糖苷下游產(chǎn)業(yè)鏈及現(xiàn)狀
> 勝利油田常規(guī)和親油性石油磺酸鹽組成、色譜、質(zhì)譜、界面張力測定(二)
> 磷脂膜破裂臨界時間和臨界表面張力值分析方法
> (Delta-8)橄欖油兩性表面活性劑之間的協(xié)同作用和陰離子表面活性劑——結(jié)果和討論、結(jié)論、致謝!
> 肺泡液-氣界面的表面張力的作用及生理意義
> 中科院江雷及團隊提出鋪展概念及其表征方法
推薦新聞Info
-
> 生物表面活性劑產(chǎn)生菌的篩選及對PAHs污染環(huán)境的修復(fù)效果研究(四)
> 生物表面活性劑產(chǎn)生菌的篩選及對PAHs污染環(huán)境的修復(fù)效果研究(三)
> 生物表面活性劑產(chǎn)生菌的篩選及對PAHs污染環(huán)境的修復(fù)效果研究(二)
> 生物表面活性劑產(chǎn)生菌的篩選及對PAHs污染環(huán)境的修復(fù)效果研究(一)
> 表面活性劑生物降解度測定方法種類及表面張力法的優(yōu)勢——結(jié)果與分析、結(jié)論
> 表面活性劑生物降解度測定方法種類及表面張力法的優(yōu)勢——摘要、實驗部分
> 炔屬二醇表面活性劑對環(huán)氧灌漿材料漿液性能、灌體的滲透性影響(二)
> 炔屬二醇表面活性劑對環(huán)氧灌漿材料漿液性能、灌體的滲透性影響(一)
> 羧酸鹽型Gemini表面活性劑GAC-31合成條件及表、界面活性研究(二)
> 羧酸鹽型Gemini表面活性劑GAC-31合成條件及表、界面活性研究(一)
不同溫度下手性離子液體及二元混合物的密度和表面張力(下)
來源:河北科技師范學(xué)院學(xué)報 瀏覽 1051 次 發(fā)布時間:2024-10-29
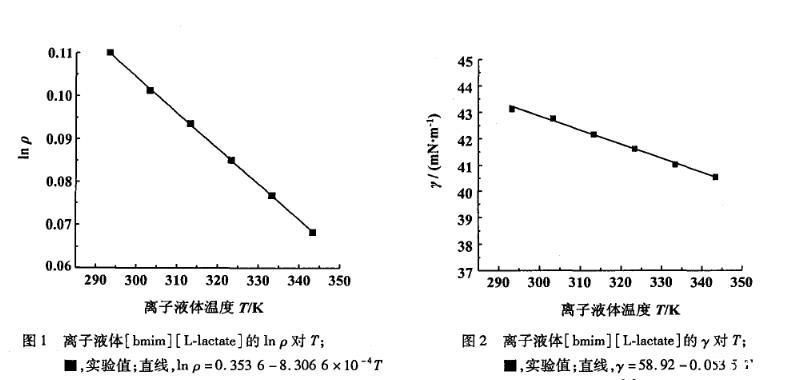
2.2[bm im][L-lactate]的表面性質(zhì)
在293.15~343.15 K溫度范圍內(nèi)實驗測得的離子液體[bmim][L-lactate]的表面張力值隨溫度的升高而減小(圖2),并且得到表面張力的經(jīng)驗方程:
式中γ為離子液體的表面張力(單位:mN·m-1),T為離子液體溫度(單位:K),a=58.92,b=0.053 5,相關(guān)系數(shù)為0.998 0。表面熵可由式(6)的斜率得到Ss=b=-(?γ/?T)P,而表面焓在293.15~343.15 K溫度范圍內(nèi)為常數(shù)Hs=a=γ-T(?γ/?T)P。[bmim][L-lactate]的表面熵為0.053 5 m J·(K·m2)-1,表面焓為58.92 mJ·m-2。

離子液體的臨界溫度(critical temperatures,Tc)是其重要的物理化學(xué)性質(zhì)之一,然而離子液體本身的性質(zhì)使得臨界溫度的實驗值很難獲得。因此,許多研究小組應(yīng)用Guggenheim經(jīng)驗方程來推測離子液體的臨界溫度。該經(jīng)驗方程的形式為:
式中Tc為離子液體的臨界溫度(單位:K),T為離子液體溫度(單位:K),γ為表面張力(單位:mN·m-1),K為經(jīng)驗常數(shù)。該方程說明臨界溫度下表面張力值為0。由式(7)估算的[bmim][L-lactate]的臨界溫度為1 169 K,比[emim][L-lactate]的臨界溫度高。Rebelo等提出離子液體沸點溫度可由Tb=0.6 Tc估算得到。計算得到的[bmim][L-lactate]的沸點溫度為701 K。
離子液體的獨特性質(zhì)之一是其具有低蒸汽壓,這可以用蒸發(fā)焓來體現(xiàn)。Zaitsau等提出了一個經(jīng)驗方程可用來估算蒸發(fā)焓:
2.3[bm im][L-lactate]+H2O二元混合物的體積性質(zhì)
不同濃度下,實驗測得的二元混合體系[bmim][L-lactate]+H2O在不同溫度下的密度值隨溫度的增加而減小(圖3);隨著體系中離子液體摩爾分數(shù)的增加而增大;離子液體濃度低時密度增加較快,離子液體濃度高時密度增加緩慢。
在二元混合物中,過量摩爾體積對研究分子聚集的特性是非常重要的。過量摩爾體積VE可由下試得到:
式中VE為過量摩爾體積(單位:cm3·mol-1),xIL為二元混合物中[bmim][L-lactate]的摩爾分率;ρ,ρ1,ρ2分別為混合物、純離子液體[bmim][L-lactate]和H2O的密度(單位:g·cm-3);M1和M2分別為[bmim][L-lactate]和H2O的摩爾質(zhì)量(單位:g·mol-1)。二元混合物的過量性質(zhì)應(yīng)用Redlich-Kister方程進行擬合:
式中Z代表過量性質(zhì),xIL為二元混合物中[bmim][L-lactate]的摩爾分率,BP代表擬合參數(shù),M為多項式的項數(shù),采用Marquardt算法進行優(yōu)化。擬合參數(shù)BP值和標準偏差(σ)列于表1。標準偏差由下式計算得到:
式中zexp,zcal和ndat分別代表實驗值、計算值和實驗次數(shù)。

表1二元混合物[bmim][L-lactate]+H2O的V E的擬合參數(shù)BP和均方偏差(σ)
在全摩爾濃度范圍內(nèi),過量摩爾體積VE均為正值(圖4)。當xIL<0.4時,VE隨著離子液體[bmim][L-lactate]濃度的增加而增加,并在xIL=0.4處取得最大值,分別為1.10,0.92,0.72 cm3·mol-1;然后VE隨著[bmim][L-lactate]濃度的增加而減小,在離子液體高濃度區(qū)域和水的高濃度區(qū)域之間出現(xiàn)了峰值。這種現(xiàn)象與[emim][BF4]+H2O和[bmim][BF4]+H2O相似。VE的正值說明與理想混合相比具有正的偏差,并且溫度越低,VE值越正。以上說明了在混合的過程中水分子減弱甚至破壞了離子液體陰陽離子間的強相互作用。
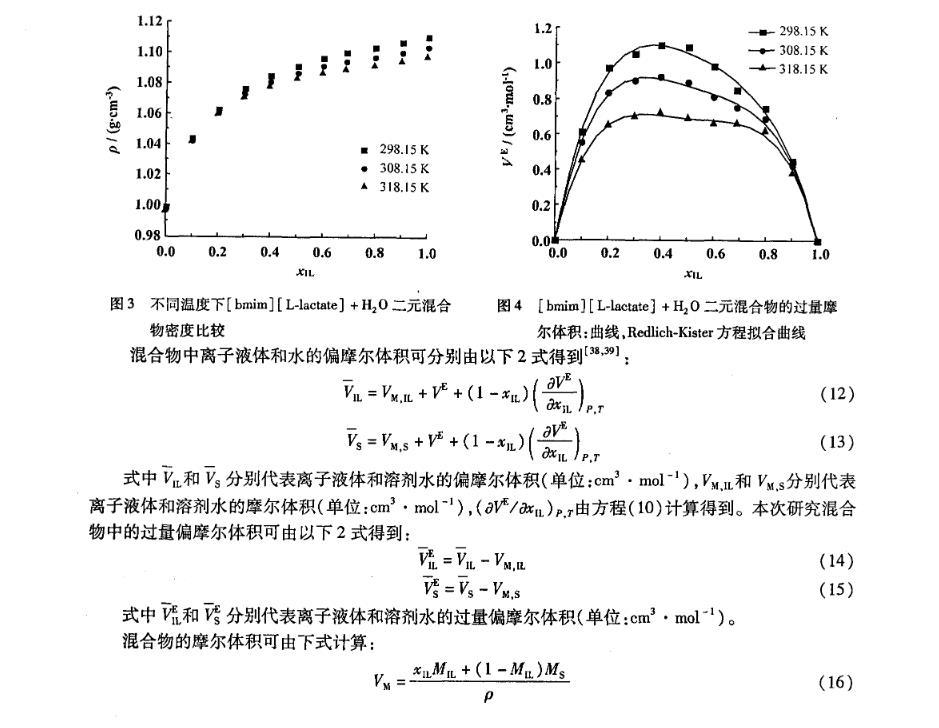
圖3不同溫度下[bmim][L-lactate]+H2 O二元混合物密度比較
圖4[bmim][L-lactate]+H2 O二元混合物的過量摩爾體積:曲線,Redlich-Kister方程擬合曲線
混合物中離子液體和水的偏摩爾體積可分別由以下2式得到:
式中VM為混合物的摩爾體積(單位:cm3·mol-1),MIL和MS分別為離子液體和溶劑水的摩爾質(zhì)量(單位:g·mol-1),xIL為離子液體在混合物中的摩爾分率,ρ為混合物的密度(單位:g·cm-3)。
二元混合物中組份i的表觀摩爾體積Vφi可由下式計算得到:
式中VM代表混合物的摩爾體積(單位:cm3·mol-1),xi代表組分i在混合物中的摩爾分率,VMj代表另一個組分j的摩爾體積(單位:cm3·mol-1)。結(jié)合式(9)和(17)可以得到本次研究混合物中的表觀摩爾體積:
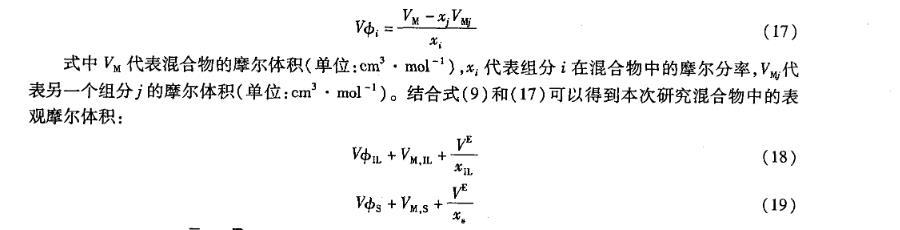
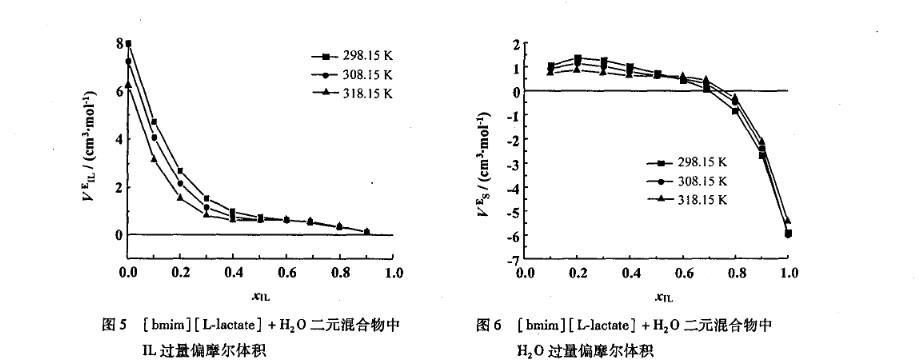
圖5[bmim][L-lactate]+H2 O二元混合物中IL過量偏摩爾體積
圖6[bmim][L-lactate]+H2O二元混合物中H2 O過量偏摩爾體積
離子液體和水的二元混合物中,離子液體的表現(xiàn)偏摩爾體積VφIL隨著溫度的升高而增大,并且在全摩爾濃度范圍內(nèi)隨著離子液體濃度的增加而減小(圖8);而水的表現(xiàn)偏摩爾體積VφS隨著溫度的升高而減小(圖9),并且與VφIL具有相反的變化趨勢。
2.4[bm im][L-lactate]+H2O二元混合物的表面性質(zhì)
不同濃度下,實驗測得的二元混合體系[bmim][L-lactate]+H2O在不同溫度下的表面張力見圖10。表面張力偏差δγ可由下試得到:

式中γ和γi分表示混合物和組分i的表面張力(單位:mN·m-1),xi代表組分i的摩爾分率。可以看出,[bmim][L-lactate]+H2O二元混合物的表面張力偏差在全摩爾濃度范圍內(nèi)為負值。溫度升高,混合物的表面張力值減小(圖10)。在離子液體摩爾濃度低時(xIL<0.06),混合物的表面張力隨著xIL的增加快速減小;而在高離子液體濃度區(qū)域,表面張力值幾乎為一常數(shù)。說明[bmim][L-lactate]在水溶液中的行為接近表面活性劑,相似的性質(zhì)出現(xiàn)在[emim][BF4],[bmim][BF4]和[hmim][BF4]的水溶液中。而這個拐點(xIL≈0.06)稱為聚集點(aggregation onset,AO)。[bmim][L-lactate]+H2O二元混合物的臨界聚集濃度(critical aggregation concentration,CAC)為2.06 mol/L,比[emim][L-lactate]+H2O二元混合物的臨界聚集濃度(1.96 mol/L)要高。
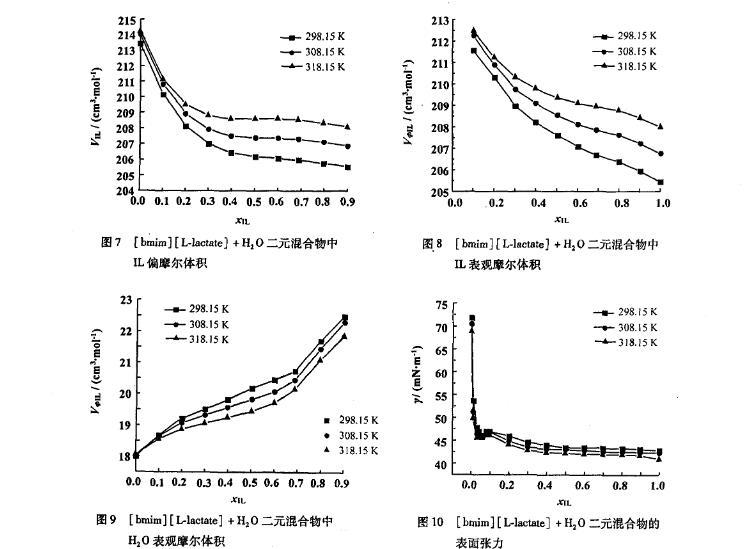
圖7[bmim][L-lactate]+H2O二元混合物中IL偏摩爾體積
圖8[bmim][L-lactate]+H2 O二元混合物中IL表觀摩爾體積
圖9[bmim][L-lactate]+H2O二元混合物中H2 O表觀摩爾體積
圖10[bmim][L-lactate]+H2 O二元混合物的表面張力
混合物的表面張力偏差(δγ)可以根據(jù)下式進行擬合

擬合參數(shù)和均方偏差見表2。
表2二元混合物[bmim][L-lactate]+H2 O擬合參數(shù)和均方偏差(σ)
3結(jié)論
本次研究測定了不同溫度下手性離子液體[bmim][L-lactate]以及二元混合物[bmim][L-lactate]+H2O的密度和表面張力。結(jié)果表明,離子液體的密度和表面張力均隨著溫度的增加而減小;并且對純離子液體的熱膨脹系數(shù)、表面熵、表面焓以及其臨界溫度進行了計算。研究了二元混合物的體積性質(zhì)(過量摩爾體積、偏摩爾體積、表觀摩爾體積、過量偏摩爾體積)、表面性質(zhì),發(fā)現(xiàn)二元混合物的密度隨溫度的增加而減小;所研究的二元混合體系的密度均隨著體系中離子液體摩爾分數(shù)的增加而增大;混合物中手性離子液體與分子溶劑間具有強的相互作用。










