合作客戶/
拜耳公司 |
同濟大學(xué) |
聯(lián)合大學(xué) |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關(guān)新聞Info
-
> R1336mzz(Z))純質(zhì)與POE潤滑油組成的混合物的表面張力測定
> 氣溶膠固定劑PAM-b-PVTES合成路線及GPC、DSC、表面張力等性能測試(四)
> 礦井瓦斯防治:表面活性劑溶液表面張力、泡沫特性及對甲烷緩釋效應(yīng)(三)
> SRA減縮劑濃度對溶液表面張力、砂漿凝結(jié)時間、水泥水化的影響(三)
> 溫度對延展型表面活性劑界面張力的影響規(guī)律
> 表面張力驅(qū)動加工方法實現(xiàn)復(fù)雜構(gòu)型多孔陶瓷的高性能制造
> 海洋環(huán)境表面活性物質(zhì)來源及對海洋飛沫氣溶膠數(shù)濃度、粒徑分布、理化性質(zhì)的影響(三)
> 接觸角遲滯時氣~液界面張力的溫度敏感性對液滴蒸發(fā)過程的影響——結(jié)果分析、結(jié)論
> 正丁醇水溶液表面張力的測定原理及計算過程
> 下雨天開車雨水影響視線,肥皂涂層破壞水的表面張力
推薦新聞Info
-
> 燒結(jié)礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(三)
> 燒結(jié)礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(二)
> 燒結(jié)礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(一)
> 如何提高非離子表面活性劑的表面張力預(yù)測精度
> 不同水淹程度的油藏環(huán)境下微生物提高采收率、采出液的表面張力與界面張力的變化(二)
> 不同水淹程度的油藏環(huán)境下微生物提高采收率、采出液的表面張力與界面張力的變化(一)
> 新型助排劑配方組分、對表/界面性能的影響及助排效果(三)
> 新型助排劑配方組分、對表/界面性能的影響及助排效果(二)
> 新型助排劑配方組分、對表/界面性能的影響及助排效果(一)
> 電噴霧質(zhì)譜離子源技術(shù)優(yōu)化策略:降低外鞘液表面張力,加速液滴溶劑蒸發(fā)
誘導(dǎo)期測定法研究NaCl的添加對碳酸鋰固-液界面張力等成核動力學(xué)參數(shù)影響——實驗部分
來源:高等學(xué)校化學(xué)學(xué)報 瀏覽 637 次 發(fā)布時間:2025-02-14
摘要
在288.15~323.15 K溫度范圍內(nèi),采用誘導(dǎo)期測定法研究了碳酸鋰(Li2CO3)在有無添加NaCl的LiCl-Na2CO3過飽和溶液中的成核動力學(xué).通過OLI電解質(zhì)與水化學(xué)物性分析軟件內(nèi)嵌的全組分模型嚴格計算Li2CO3在溶液中的過飽和度,研究了溫度、過飽和度和NaCl的添加量對Li2CO3成核誘導(dǎo)期的影響,并結(jié)合經(jīng)典初級成核理論計算了活化能、固-液界面張力和接觸角等成核動力學(xué)參數(shù).結(jié)果顯示,在相同的過飽和度下,NaCl的添加使得Li2CO3的成核誘導(dǎo)期增長;添加NaCl后Li2CO3成核反應(yīng)的活化能從63.69 kJ/mol(溶液中Cl?的超額含量Y=0)增加到72.85 kJ/mol(溶液中Cl?的超額含量Y=0.5),表明NaCl的添加抑制了Li2CO3的成核.采用經(jīng)典初級成核理論研究了Li2CO3的兩種成核機制(均相成核和非均相成核),計算結(jié)果表明,在同一溫度下,均相成核時的固-液界面張力始終大于非均相成核時的固-液界面張力,溫度的變化以及NaCl的添加對固-液界面張力的影響均可忽略.
碳酸鋰(Li2CO3)是鋰的基礎(chǔ)產(chǎn)品之一,占鋰總需求量的39%以上[1],被廣泛應(yīng)用于電池、能源、陶瓷、冶金及醫(yī)藥等重要領(lǐng)域[2~4].隨著全球新能源的不斷開發(fā)以及儲能鋰電池的高速發(fā)展,Li2CO3因其作為鋰電池生產(chǎn)的重要原料而備受矚目[5~7].我國對Li2CO3的需求量逐年快速遞增,預(yù)計到2025年會增加到45萬噸左右[8].但是我國鋰原料供應(yīng)的對外依存度仍高達70%以上[9,10],因此加快推進Li2CO3的工業(yè)生產(chǎn)對我國的能源安全具有重要的戰(zhàn)略意義.
我國超過71%的鋰資源賦存于鹽湖鹵水中,而且鹽湖鹵水提鋰具有高純、量大、綠色及經(jīng)濟的優(yōu)勢,因此鹽湖鹵水提鋰是目前乃至未來很長一段時間內(nèi)我國重要的Li2CO3生產(chǎn)渠道[11,12].鹽湖鹵水生產(chǎn)Li2CO3的常用方法是向鹵水LiCl中加入沉淀劑Na2CO3,從而將Li2CO3沉淀結(jié)晶出來.在結(jié)晶過程中,Li2CO3晶體的成核現(xiàn)象直接影響到其后續(xù)的生長過程以及最終晶體產(chǎn)品的質(zhì)量,因此研究Li2CO3在鹽湖提鋰體系中的成核動力學(xué),可為結(jié)晶過程的優(yōu)化以及結(jié)晶器的設(shè)計提供重要依據(jù).影響晶體成核的因素有溫度、過飽和度、添加物或雜質(zhì)的含量等[13,14].由于NaCl是鹽湖鹵水中的主要溶質(zhì)之一,因此,研究NaCl的添加對Li2CO3成核的影響非常重要.
晶體成核動力學(xué)中涉及的一個關(guān)鍵參數(shù)是成核誘導(dǎo)期(tind),它是將成核理論和實驗研究關(guān)聯(lián)起來的重要橋梁[15].成核誘導(dǎo)期是指從溶液的過飽和建立到晶核生成所需要的時間[16,17],通常采用實驗方法來測定.目前Li2CO3成核動力學(xué)的研究體系包括單一LiHCO3溶液體系和Li2SO4-Na2CO3溶液體系等[13,18],但鮮少有針對鹽湖提鋰體系的研究.此外,由于多元過飽和溶液中離子活度系數(shù)的數(shù)值很難確定,所以在研究晶體的成核動力學(xué)時通常用溶液濃度來估算過飽和度[19],這會導(dǎo)致研究結(jié)果出現(xiàn)較大的偏差.而由Marshall Rafal博士創(chuàng)建的OLI電解質(zhì)與水化學(xué)物性分析軟件[20]集理論模型、數(shù)據(jù)庫、數(shù)據(jù)回歸和應(yīng)用為一體,其內(nèi)嵌的基于全組分的模型能完整嚴格地計算多組分溶液體系中的熱力學(xué)數(shù)據(jù).
本文研究了Li2CO3在有無添加NaCl的LiCl-Na2CO3過飽和溶液中的成核動力學(xué),其中,溫度范圍為288.15~323.15 K,過飽和度范圍為5.76~31.73.采用具有良好穩(wěn)定性和靈敏度的激光在線法[21]測量了Li2CO3的成核誘導(dǎo)期.溶液中Li2CO3的過飽和度由OLI電解質(zhì)與水化學(xué)物性分析軟件[20]內(nèi)嵌的全組分熱力學(xué)模型嚴格計算,其中,溶液中離子的活度系數(shù)由嵌入的Bromley-Zemaitis方程[22,23]來計算,熱力學(xué)平衡常數(shù)由嵌入的HKF模型[24~26]來計算.系統(tǒng)考察了過飽和度、溫度以及NaCl的添加對Li2CO3成核動力學(xué)的影響,并結(jié)合經(jīng)典初級成核理論計算了活化能、固-液界面張力和接觸角等成核動力學(xué)參數(shù).
1實驗部分
1.1試劑與儀器
LiCl·H2O(純度≥99%)、Na2CO3(純度≥99.8%)和NaCl(純度≥99.5%),分析純,國藥集團化學(xué)試劑有限公司;去離子水(電導(dǎo)率<0.1μS/cm).
超微量分析天平(精確度±0.0001 g),芬蘭Kibron公司;84-1A型磁力攪拌器,上海司樂儀器有限公司;激光在線監(jiān)測裝置,北京市東西分析儀器有限公司.
1.2實驗過程
成核誘導(dǎo)期測定實驗在一個通有循環(huán)水的玻璃夾套反應(yīng)釜(容積為150 mL)中進行,釜內(nèi)溶液濁度的變化通過一套激光在線裝置來監(jiān)測,實驗裝置見Scheme 1.將50 mL濃度為1.352~3.088 mol/L的LiCl溶液置于反應(yīng)釜中,使用循環(huán)水將溶液溫度升高或降低到某一數(shù)值.開啟磁力攪拌器和激光在線監(jiān)測裝置,待溶液溫度及激光數(shù)據(jù)采集器數(shù)值恒定后,將50 mL相同溫度的Na2CO3溶液迅速加入LiCl溶液中并記錄時間.激光采集器數(shù)值先是恒定一段時間不變,然后開始降低;緊接著可以觀察到溶液變渾濁(Li2CO3晶核生成),而且隨激光強度數(shù)值的降低越來越渾濁;當激光強度的數(shù)值不再變化時,結(jié)束實驗.所記錄的激光強度數(shù)值恒定不變的時間段即為Li2CO3的成核誘導(dǎo)期.在以上實驗中,LiCl溶液的濃度均為Na2CO3溶液濃度的2倍.
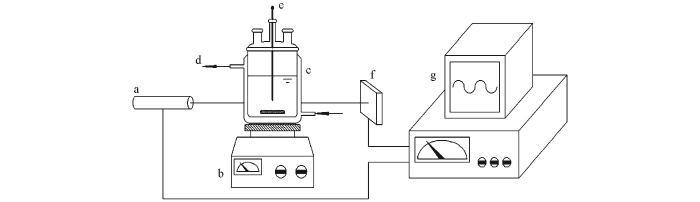
a. Laser generator; b. magnetic stirrer; c. jacketed reactor; d. circulating water; e. thermometer; f. laser detector; g. data acquisition.
在研究NaCl添加量對成核誘導(dǎo)期的影響實驗中,將Na2CO3溶液加入反應(yīng)釜以前要先加入一定質(zhì)量的NaCl固體,其余的實驗步驟同上.為了便于計算,將Cl?的超額含量定義如下[27]:
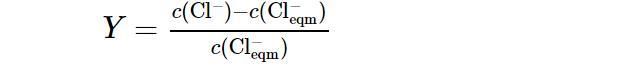
式中:c(Cl?)(mol/L)為溶液中Cl?的總摩爾濃度;c(Cl?eqm)(mol/L)為由于NaCl的加入而增加的Cl?的摩爾濃度.每組實驗均在Cl?的超額含量Y=0.5的條件下進行.










